Encyclopédie chimique. Tome Ier.- Introduction. 2e fascicule : Texte
- Collections
- Chimie
- Classe de ressource
- Book
- DESCRIPTION
- TABLE DES MATIÈRES
- VOIR PLUS
- Identifiant
- ark:/13685/pharma_018935x02
- Titre
- Encyclopédie chimique. Tome Ier.- Introduction. 2e fascicule : Texte
- Créateur
-
Frémy, Edmond
- Rôle
- Directeur
- Date
- 1882
- Éditeur
- Paris : Dunod
- Partie de
- Encyclopédie chimique.
- Siècle
- XIXe siècle
- Format
- Nombre de vues : 931
- Notes
- Encyclopédie en 94 vol. Les volumes 30(2), 44, 77 et 78 n'ont pas été publiés.
- Source
- Université Paris Cité. BIU Santé Pharmacie, inv. 18935x02
- Date de mise en ligne
- 2 février 2012
- Propriétaire
- Université Paris Cité. BIU Santé Pharmacie
- Licence
- Licence Ouverte
- Table des matières
-
![0001 - Page sans numérotation - [Page de titre]](https://numerabilis.u-paris.fr/iiif/2/bibnum:pharma_018935x02:0001/square/200,/0/default.jpg) 0001 - Page sans numérotation - [Page de titre]
0001 - Page sans numérotation - [Page de titre]
-
 0002 - Page sans numérotation - Table des chapitres
0002 - Page sans numérotation - Table des chapitres
-
![0003 - Page 1 - Essai de mécanique chimique fondée sur la thermochimie [M. Berthelot]. Introduction. 1er. - La théorie mécaniquede la chaleur et la chimie](https://numerabilis.u-paris.fr/iiif/2/bibnum:pharma_018935x02:0003/square/200,/0/default.jpg) 0003 - Page 1 - Essai de mécanique chimique fondée sur la thermochimie [M. Berthelot]. Introduction. 1er. - La théorie mécaniquede la chaleur et la chimie
0003 - Page 1 - Essai de mécanique chimique fondée sur la thermochimie [M. Berthelot]. Introduction. 1er. - La théorie mécaniquede la chaleur et la chimie
-
 0004 - Page 2 - 2. - Définitions
0004 - Page 2 - 2. - Définitions
-
 0006 - Page 4 - 3. - Constitution physique de la matière
0006 - Page 4 - 3. - Constitution physique de la matière
-
 0008 - Page 6 - 4. - Constitution chimique de la matière
0008 - Page 6 - 4. - Constitution chimique de la matière
-
 0010 - Page 8 - 5. - Affinité / 6. - Dégagement de chaleur dans les actions chimiques
0010 - Page 8 - 5. - Affinité / 6. - Dégagement de chaleur dans les actions chimiques
-
 0012 - Page 10 - 7. Principes de la mécanique chimique
0012 - Page 10 - 7. Principes de la mécanique chimique
-
 0013 - Page 11 - 8. - Plan du présent ouvrage
0013 - Page 11 - 8. - Plan du présent ouvrage
-
 0014 - Page 12 - Livre premier. Affinité chimique et calorimètre. Chapitre Premier. Principe des travaux moléculaires
0014 - Page 12 - Livre premier. Affinité chimique et calorimètre. Chapitre Premier. Principe des travaux moléculaires
-
 0016 - Page 14 - Livre premier. Affinité chimique et calorimètre. Chapitre Premier. Principe des travaux moléculaires
0016 - Page 14 - Livre premier. Affinité chimique et calorimètre. Chapitre Premier. Principe des travaux moléculaires
-
 0017 - Page 15 - Chapitre II. Principe de l'équivalence calorifique des transformations chimiques, autrement dit principe de l'état initial et de l'état final
0017 - Page 15 - Chapitre II. Principe de l'équivalence calorifique des transformations chimiques, autrement dit principe de l'état initial et de l'état final
-
 0022 - Page 20 - Livre II. Méthodes expérimentales. Chapitre Premier. Introduction
0022 - Page 20 - Livre II. Méthodes expérimentales. Chapitre Premier. Introduction
-
 0023 - Page 21 - Chapitre II. Appareils calorimétriques ordinaires. Division du sujet
0023 - Page 21 - Chapitre II. Appareils calorimétriques ordinaires. Division du sujet
-
 0030 - Page 28 - Livre III. Données numériques. Chapitre Premier. Généralités
0030 - Page 28 - Livre III. Données numériques. Chapitre Premier. Généralités
-
 0031 - Page 29 - Livre IV. De la combinaison et de la décomposition chimiques. Chapitre premier. Problèmes généraux de la mécanique chimique
0031 - Page 29 - Livre IV. De la combinaison et de la décomposition chimiques. Chapitre premier. Problèmes généraux de la mécanique chimique
-
 0034 - Page 32 - Chapitre II. De la combinaison chimique
0034 - Page 32 - Chapitre II. De la combinaison chimique
-
 0048 - Page 46 - Chapitre III. De la décomposition chimique
0048 - Page 46 - Chapitre III. De la décomposition chimique
-
 0049 - Page 47 - Chapitre IV. Décompositions limitées et équilibres chimiques. - Systèmes Homogènes
0049 - Page 47 - Chapitre IV. Décompositions limitées et équilibres chimiques. - Systèmes Homogènes
-
 0051 - Page 49 - Chapitre V. Equilibres simples dans les systèmes hétérogènes
0051 - Page 49 - Chapitre V. Equilibres simples dans les systèmes hétérogènes
-
 0053 - Page 51 - Chapitre VII. Equilibres chimiques dans les dissolutions
0053 - Page 51 - Chapitre VII. Equilibres chimiques dans les dissolutions
-
 0055 - Page 53 - Chapitre VIII. Sur la constitution des sels dissous. - Acides forts et acides faibles
0055 - Page 53 - Chapitre VIII. Sur la constitution des sels dissous. - Acides forts et acides faibles
-
 0057 - Page 55 - Chapitre IX. Constitution des sels dissous. - Bases faibles et oxydes métalliques
0057 - Page 55 - Chapitre IX. Constitution des sels dissous. - Bases faibles et oxydes métalliques
-
 0058 - Page 56 - Chapitre XI. Réactions chimiques produites par les énergies électriques. Division du sujet. Chapitre XII. Actions chimiques produites par les énergies lumineuses
0058 - Page 56 - Chapitre XI. Réactions chimiques produites par les énergies électriques. Division du sujet. Chapitre XII. Actions chimiques produites par les énergies lumineuses
-
 0061 - Page 59 - Livre V. Statique Chimique. Chapitre Premier. Principe du travail maximum
0061 - Page 59 - Livre V. Statique Chimique. Chapitre Premier. Principe du travail maximum
-
 0063 - Page 61 - Principe du travail maximum
0063 - Page 61 - Principe du travail maximum
-
 0064 - Page 62 - Théorème de la nécessité des réactions
0064 - Page 62 - Théorème de la nécessité des réactions
-
 0066 - Page 64 - Chapitre II. Action des éléments sur les composés binaires
0066 - Page 64 - Chapitre II. Action des éléments sur les composés binaires
-
 0067 - Page 65 - Chapitre VI. Déplacements réciproques des bases
0067 - Page 65 - Chapitre VI. Déplacements réciproques des bases
-
 0068 - Page 66 - Chapitre VII. Doubles décompositions salines. Conclusions générales
0068 - Page 66 - Chapitre VII. Doubles décompositions salines. Conclusions générales
-
![0071 - Page 69 - Etudes sur les Equilibres Chimiques. [M. Georges Lemoine]. Introduction](https://numerabilis.u-paris.fr/iiif/2/bibnum:pharma_018935x02:0071/square/200,/0/default.jpg) 0071 - Page 69 - Etudes sur les Equilibres Chimiques. [M. Georges Lemoine]. Introduction
0071 - Page 69 - Etudes sur les Equilibres Chimiques. [M. Georges Lemoine]. Introduction
-
 0073 - Page 71 - Première Partie. Faits d'expériences. Notions générales
0073 - Page 71 - Première Partie. Faits d'expériences. Notions générales
-
 0077 - Page 75 - Chapitre Premier. Equilibres entre la chaleur et l'affinité chimique. 1. - Transformations allotropiques : systèmes non homogènes
0077 - Page 75 - Chapitre Premier. Equilibres entre la chaleur et l'affinité chimique. 1. - Transformations allotropiques : systèmes non homogènes
-
 0078 - Page 76 - Phosphore
0078 - Page 76 - Phosphore
-
 0086 - Page 84 - Cyanogène
0086 - Page 84 - Cyanogène
-
 0087 - Page 85 - Acide cyanique
0087 - Page 85 - Acide cyanique
-
 0088 - Page 86 - 2. - Transformations allotropiques : systèmes homogènes
0088 - Page 86 - 2. - Transformations allotropiques : systèmes homogènes
-
 0089 - Page 87 - Densités des vapeurs de soufre, d'acide hypoazotique et d'acide acétique
0089 - Page 87 - Densités des vapeurs de soufre, d'acide hypoazotique et d'acide acétique
-
 0092 - Page 90 - Densité de vapeur de l'iode
0092 - Page 90 - Densité de vapeur de l'iode
-
 0094 - Page 92 - Conclusion
0094 - Page 92 - Conclusion
-
 0095 - Page 93 - 3. - Dissociation : Systèmes non homogènes
0095 - Page 93 - 3. - Dissociation : Systèmes non homogènes
-
 0096 - Page 94 - Carbonate de chaux
0096 - Page 94 - Carbonate de chaux
-
 0098 - Page 96 - Sels hydratés : efflorescence
0098 - Page 96 - Sels hydratés : efflorescence
-
 0102 - Page 100 - Carbonates de manganèse et d'argent
0102 - Page 100 - Carbonates de manganèse et d'argent
-
 0104 - Page 102 - Bicarbonates alcalins / Bioxyde de mercure
0104 - Page 102 - Bicarbonates alcalins / Bioxyde de mercure
-
 0105 - Page 103 - Oxyde d'iridium / Chlorures ammoniacaux
0105 - Page 103 - Oxyde d'iridium / Chlorures ammoniacaux
-
 0107 - Page 105 - Combinaison d'oxyde de carbone et de sous-chlorure de cuivre / Chlorures de soufre / Hydrures métalliques
0107 - Page 105 - Combinaison d'oxyde de carbone et de sous-chlorure de cuivre / Chlorures de soufre / Hydrures métalliques
-
 0109 - Page 107 - Hydrate de chlore
0109 - Page 107 - Hydrate de chlore
-
 0110 - Page 108 - Sulfure de carbone / Corps composés susceptibles de se produire à une température très supérieure à celle qui détermine leur décomposition / Hydrogène sélénie
0110 - Page 108 - Sulfure de carbone / Corps composés susceptibles de se produire à une température très supérieure à celle qui détermine leur décomposition / Hydrogène sélénie
-
 0112 - Page 110 - Ammoniac et acide carbonique
0112 - Page 110 - Ammoniac et acide carbonique
-
 0119 - Page 117 - 4. - Dissociation : systèmes homogènes. Bromhydrate d'amylène
0119 - Page 117 - 4. - Dissociation : systèmes homogènes. Bromhydrate d'amylène
-
 0120 - Page 118 - Perchlorure de phosphore
0120 - Page 118 - Perchlorure de phosphore
-
 0122 - Page 120 - Expériences de M. Cahours / Expériences de M. Wurtz / Expériences de MM. Troost et Hautefeuille
0122 - Page 120 - Expériences de M. Cahours / Expériences de M. Wurtz / Expériences de MM. Troost et Hautefeuille
-
 0124 - Page 122 - Acide iodhydrique
0124 - Page 122 - Acide iodhydrique
-
 0131 - Page 129 - Hydrogène et vapeur d'iode chauffés à 440 degrés en proportions variables, la pression restant constante
0131 - Page 129 - Hydrogène et vapeur d'iode chauffés à 440 degrés en proportions variables, la pression restant constante
-
 0135 - Page 133 - Combinaison de l'oxyde de méthyle à l'acide chlorhydrique
0135 - Page 133 - Combinaison de l'oxyde de méthyle à l'acide chlorhydrique
-
 0144 - Page 142 - Calomel
0144 - Page 142 - Calomel
-
 0145 - Page 143 - Chlorhydrate d'ammoniaque / Bisulfhydrate d'ammoniaque / Hydrate de chloral
0145 - Page 143 - Chlorhydrate d'ammoniaque / Bisulfhydrate d'ammoniaque / Hydrate de chloral
-
 0148 - Page 146 - Dissociation dans les dissolutions
0148 - Page 146 - Dissociation dans les dissolutions
-
 0149 - Page 147 - Transformations réciproques de l'alun de chrome
0149 - Page 147 - Transformations réciproques de l'alun de chrome
-
 0150 - Page 148 - Bicarbonates de chaux et de baryte
0150 - Page 148 - Bicarbonates de chaux et de baryte
-
 0153 - Page 151 - Chapitre II. Equilibres électriques. Ozone
0153 - Page 151 - Chapitre II. Equilibres électriques. Ozone
-
 0155 - Page 153 - Expériences de M. Bunsen sur les gaz combustibles
0155 - Page 153 - Expériences de M. Bunsen sur les gaz combustibles
-
 0159 - Page 157 - Acide hypoazotique / Ammoniac
0159 - Page 157 - Acide hypoazotique / Ammoniac
-
 0160 - Page 158 - Acide carbonique
0160 - Page 158 - Acide carbonique
-
 0162 - Page 160 - Vapeur d'eau / Acétylène
0162 - Page 160 - Vapeur d'eau / Acétylène
-
 0163 - Page 161 - Acide cyanhydrique
0163 - Page 161 - Acide cyanhydrique
-
 0164 - Page 162 - Equilibres complexes
0164 - Page 162 - Equilibres complexes
-
 0165 - Page 163 - Chapitre III. Equilibres entre deux réactions chimiques. 1. - Systèmes homogènes. Ethérification dans les systèmes liquides
0165 - Page 163 - Chapitre III. Equilibres entre deux réactions chimiques. 1. - Systèmes homogènes. Ethérification dans les systèmes liquides
-
 0175 - Page 173 - Ethérification dans les systèmes gazeux
0175 - Page 173 - Ethérification dans les systèmes gazeux
-
 0177 - Page 175 - Décomposition des sels par l'eau : systèmes homogènes : équilibres dans les dissolutions
0177 - Page 175 - Décomposition des sels par l'eau : systèmes homogènes : équilibres dans les dissolutions
-
 0182 - Page 180 - Partage d'une base entre deux acides dans les dissolutions
0182 - Page 180 - Partage d'une base entre deux acides dans les dissolutions
-
 0186 - Page 184 - Partage d'un acide entre deux bases dans une dissolution / Action réciproque de deux sels solubles dans les dissolutions
0186 - Page 184 - Partage d'un acide entre deux bases dans une dissolution / Action réciproque de deux sels solubles dans les dissolutions
-
 0189 - Page 187 - Doubles décompositions par voie sèche, dans les systèmes homogènes
0189 - Page 187 - Doubles décompositions par voie sèche, dans les systèmes homogènes
-
 0190 - Page 188 - Statique chimique des hydrocarbures pyrogénés
0190 - Page 188 - Statique chimique des hydrocarbures pyrogénés
-
 0193 - Page 191 - 2. - Systèmes non homogènes. Action réciproque des sels solubles et de sels insolubles
0193 - Page 191 - 2. - Systèmes non homogènes. Action réciproque des sels solubles et de sels insolubles
-
 0197 - Page 195 - Doubles décompositions par voie sèche, dans les systèmes homogènes
0197 - Page 195 - Doubles décompositions par voie sèche, dans les systèmes homogènes
-
 0198 - Page 196 - Action de l'eau sur le fer et de l'hydrogène sur l'oxyde de fer
0198 - Page 196 - Action de l'eau sur le fer et de l'hydrogène sur l'oxyde de fer
-
 0200 - Page 198 - Décomposition des dissolutions salines par l'eau : systèmes non homogènes
0200 - Page 198 - Décomposition des dissolutions salines par l'eau : systèmes non homogènes
-
 0201 - Page 199 - Décomposition des sulfures par l'eau / Réaction des carbonates métalliques sur les carbonates neutres alcalins
0201 - Page 199 - Décomposition des sulfures par l'eau / Réaction des carbonates métalliques sur les carbonates neutres alcalins
-
 0207 - Page 205 - Deuxième partie. Lois générales des équilibres chimiques et leur interprétation. Chapitre Premier. Dissociation. 1. - Lois générales de la dissociation, données par l'expérience. Existence d'une limite
0207 - Page 205 - Deuxième partie. Lois générales des équilibres chimiques et leur interprétation. Chapitre Premier. Dissociation. 1. - Lois générales de la dissociation, données par l'expérience. Existence d'une limite
-
 0208 - Page 206 - Systèmes non homogènes / Systèmes homogènes / 2. - Interprétation des lois générales de la dissociation. Mode de production de la limite
0208 - Page 206 - Systèmes non homogènes / Systèmes homogènes / 2. - Interprétation des lois générales de la dissociation. Mode de production de la limite
-
 0212 - Page 210 - Interprétation des lois relatives aux systèmes homogènes
0212 - Page 210 - Interprétation des lois relatives aux systèmes homogènes
-
 0214 - Page 212 - Interprétation des lois relatives aux systèmes non homogènes
0214 - Page 212 - Interprétation des lois relatives aux systèmes non homogènes
-
 0217 - Page 215 - 3. - Circonstances diverses à l'appui des interprétations précédentes. Cas de décompositions indéfinies
0217 - Page 215 - 3. - Circonstances diverses à l'appui des interprétations précédentes. Cas de décompositions indéfinies
-
 0218 - Page 216 - Décompositions opérées à l'air libre / Oscillations dans la limite de dissociation pour certains systèmes non homogènes
0218 - Page 216 - Décompositions opérées à l'air libre / Oscillations dans la limite de dissociation pour certains systèmes non homogènes
-
 0219 - Page 217 - Dissociation en présence d'un réactif absorbant / Décompositions opérées sous l'influence de la lumière
0219 - Page 217 - Dissociation en présence d'un réactif absorbant / Décompositions opérées sous l'influence de la lumière
-
 0220 - Page 218 - Décompositions opérées sous l'influence des corps poreux
0220 - Page 218 - Décompositions opérées sous l'influence des corps poreux
-
 0221 - Page 219 - Chapitre II. Lois générales des équilibres électriques
0221 - Page 219 - Chapitre II. Lois générales des équilibres électriques
-
 0223 - Page 221 - Chapitre III. Lois générales des équiibres entre deux réactions chimiques. Production d'une limite
0223 - Page 221 - Chapitre III. Lois générales des équiibres entre deux réactions chimiques. Production d'une limite
-
 0224 - Page 222 - Systèmes non homogènes
0224 - Page 222 - Systèmes non homogènes
-
 0225 - Page 223 - Systèmes homogènes
0225 - Page 223 - Systèmes homogènes
-
 0227 - Page 225 - Troisième partie. Etudes sur la vitesse des réactions : applications aux équilibres chimiques. Notions générales. Nécessité de l'étude de la vitesse des réactions
0227 - Page 225 - Troisième partie. Etudes sur la vitesse des réactions : applications aux équilibres chimiques. Notions générales. Nécessité de l'étude de la vitesse des réactions
-
 0229 - Page 227 - Marche suivie dans l'étude de la vitesse des réactions
0229 - Page 227 - Marche suivie dans l'étude de la vitesse des réactions
-
 0230 - Page 228 - Chapitre Premier. Décomposition non limitées. Théorie général. Influence de la température
0230 - Page 228 - Chapitre Premier. Décomposition non limitées. Théorie général. Influence de la température
-
 0231 - Page 229 - Applications
0231 - Page 229 - Applications
-
 0233 - Page 231 - Vitesse de destruction du sucre dans la fermentation
0233 - Page 231 - Vitesse de destruction du sucre dans la fermentation
-
 0234 - Page 232 - Chapitre II. Combinaisons non limitées. Principes généraux
0234 - Page 232 - Chapitre II. Combinaisons non limitées. Principes généraux
-
 0235 - Page 233 - 1. - Systèmes non homogènes. Théorie générale
0235 - Page 233 - 1. - Systèmes non homogènes. Théorie générale
-
 0237 - Page 235 - Expériences sur la décomposition des carbonates par les acides
0237 - Page 235 - Expériences sur la décomposition des carbonates par les acides
-
 0239 - Page 237 - Expériences relatives à la réaction des acides étendus sur les métaux
0239 - Page 237 - Expériences relatives à la réaction des acides étendus sur les métaux
-
 0240 - Page 238 - Expériences sur le déplacement des métaux les uns par les autres dans les dissolutions salines
0240 - Page 238 - Expériences sur le déplacement des métaux les uns par les autres dans les dissolutions salines
-
 0241 - Page 239 - Substitution du brome dans les acides organiques de la série grasse / Vitesse d'absorption du chlore par la chaux dans la fabrication du chlorure de chaux / Expériences sur la décomposition du chlorhydrate de térébenthène par l'eau
0241 - Page 239 - Substitution du brome dans les acides organiques de la série grasse / Vitesse d'absorption du chlore par la chaux dans la fabrication du chlorure de chaux / Expériences sur la décomposition du chlorhydrate de térébenthène par l'eau
-
 0242 - Page 240 - 2. - Systèmes non homogènes. Théorie générale
0242 - Page 240 - 2. - Systèmes non homogènes. Théorie générale
-
 0245 - Page 243 - Théorie fondée sur la probabilité de rencontre des molécules
0245 - Page 243 - Théorie fondée sur la probabilité de rencontre des molécules
-
 0250 - Page 248 - Conclusion : deux cas à distinguer pour la vitesse de la combinaison suivant la pression
0250 - Page 248 - Conclusion : deux cas à distinguer pour la vitesse de la combinaison suivant la pression
-
 0251 - Page 249 - Théorie de MM. Vernon Harcourt et William Esson
0251 - Page 249 - Théorie de MM. Vernon Harcourt et William Esson
-
 0255 - Page 253 - Expériences sur la réaction de l'acide permanganique et de l'acide oxalique
0255 - Page 253 - Expériences sur la réaction de l'acide permanganique et de l'acide oxalique
-
 0256 - Page 254 - Expériences sur l'inversion du sucre de canne par les acides
0256 - Page 254 - Expériences sur l'inversion du sucre de canne par les acides
-
 0257 - Page 255 - Chapitre III. Dissociation. Principes de la théorie. 1. - Dissociation des systèmes homogènes. Théorie générale de la dissociation des systèmes homogènes
0257 - Page 255 - Chapitre III. Dissociation. Principes de la théorie. 1. - Dissociation des systèmes homogènes. Théorie générale de la dissociation des systèmes homogènes
-
 0260 - Page 258 - Dissociation de l'acide iodhydrique
0260 - Page 258 - Dissociation de l'acide iodhydrique
-
 0271 - Page 269 - Combinaison d'oxyde de méthyle et d'acide chlorhydrique
0271 - Page 269 - Combinaison d'oxyde de méthyle et d'acide chlorhydrique
-
 0281 - Page 279 - Dissociation du bicarbonate de chaux
0281 - Page 279 - Dissociation du bicarbonate de chaux
-
 0284 - Page 282 - 2. - Dissociation des systèmes non homogènes. Théorie générale
0284 - Page 282 - 2. - Dissociation des systèmes non homogènes. Théorie générale
-
 0285 - Page 283 - Acide carbonique et ammoniac
0285 - Page 283 - Acide carbonique et ammoniac
-
 0290 - Page 288 - Chapitre IV. Transformations allotropiques. Rapprochements entre les transformations allotropiques et la dissociation. 1. - Transformations allotropiques des systèmes homogènes
0290 - Page 288 - Chapitre IV. Transformations allotropiques. Rapprochements entre les transformations allotropiques et la dissociation. 1. - Transformations allotropiques des systèmes homogènes
-
 0293 - Page 291 - 2. - Transformations allotropiques des systèmes non homogènes / Théorie générale de la transformation allotropique du phosphore
0293 - Page 291 - 2. - Transformations allotropiques des systèmes non homogènes / Théorie générale de la transformation allotropique du phosphore
-
 0296 - Page 294 - Application aux expériences sur le phosphore ordinaire
0296 - Page 294 - Application aux expériences sur le phosphore ordinaire
-
 0297 - Page 295 - Application aux expériences où le phosphore rouge se transforme en présence du cuivre
0297 - Page 295 - Application aux expériences où le phosphore rouge se transforme en présence du cuivre
-
 0298 - Page 296 - Application aux expériences où l'on chauffe du phosphore rouge dans le vide
0298 - Page 296 - Application aux expériences où l'on chauffe du phosphore rouge dans le vide
-
 0300 - Page 298 - Transformation du phosphore rouge en présence d'un appareil de condensation
0300 - Page 298 - Transformation du phosphore rouge en présence d'un appareil de condensation
-
 0302 - Page 300 - Transformation du phosphore ordinaire maintenu liquide
0302 - Page 300 - Transformation du phosphore ordinaire maintenu liquide
-
 0303 - Page 301 - Chapitre V. Théorie de la dissociation d'après MM. Guldberg et Waage. Principes généraux
0303 - Page 301 - Chapitre V. Théorie de la dissociation d'après MM. Guldberg et Waage. Principes généraux
-
 0304 - Page 302 - Théorie de l'action de masse en négligeant les forces secondaires
0304 - Page 302 - Théorie de l'action de masse en négligeant les forces secondaires
-
 0307 - Page 305 - Dissociation d'un corps solide donnant par sa décomposition des corps qui sont tous gazeux
0307 - Page 305 - Dissociation d'un corps solide donnant par sa décomposition des corps qui sont tous gazeux
-
 0310 - Page 308 - Dissociation d'un gaz donnant par sa décomposition des produits gazeux
0310 - Page 308 - Dissociation d'un gaz donnant par sa décomposition des produits gazeux
-
 0317 - Page 315 - Chapitre VI. Comparaison des diverses théories de la dissociation fondées sur l'étude de la vitesse des réactions
0317 - Page 315 - Chapitre VI. Comparaison des diverses théories de la dissociation fondées sur l'étude de la vitesse des réactions
-
 0321 - Page 319 - Chapitre VII. Equilibres entre deux réactions chimiques. Principes de la théorie
0321 - Page 319 - Chapitre VII. Equilibres entre deux réactions chimiques. Principes de la théorie
-
 0322 - Page 320 - 1. - Théorie générale des réactions limitées dans les dissolutions
0322 - Page 320 - 1. - Théorie générale des réactions limitées dans les dissolutions
-
 0324 - Page 322 - 2.- Phénomènes d'éthérification dans les systèmes gazeux
0324 - Page 322 - 2.- Phénomènes d'éthérification dans les systèmes gazeux
-
 0325 - Page 323 - 3. - Phénomènes d'éthérification dans les systèmes liquides / Etude de la vitesse de la réaction
0325 - Page 323 - 3. - Phénomènes d'éthérification dans les systèmes liquides / Etude de la vitesse de la réaction
-
 0326 - Page 324 - Etude de la limite
0326 - Page 324 - Etude de la limite
-
 0334 - Page 332 - Influences des actions secondaires dans l'éthérification
0334 - Page 332 - Influences des actions secondaires dans l'éthérification
-
 0340 - Page 338 - 4. - Décomposition d'un sel insoluble par un sel soluble. Théorie générale
0340 - Page 338 - 4. - Décomposition d'un sel insoluble par un sel soluble. Théorie générale
-
 0342 - Page 340 - Applications
0342 - Page 340 - Applications
-
 0343 - Page 341 - Influence des actions secondaires. Réactions du fer sur la vapeur d'eau et de l'oxyde de fer sur l'hydrogène
0343 - Page 341 - Influence des actions secondaires. Réactions du fer sur la vapeur d'eau et de l'oxyde de fer sur l'hydrogène
-
 0345 - Page 343 - Quatrième partie. Etudes des équilibres chimiques d'après la théorie mécanique de la chaleur. Chapitre Premier. Dissociations des systèmes non homogènes / Théorie de la dissociation des systèmes non homogènes, d'après M. Peslin
0345 - Page 343 - Quatrième partie. Etudes des équilibres chimiques d'après la théorie mécanique de la chaleur. Chapitre Premier. Dissociations des systèmes non homogènes / Théorie de la dissociation des systèmes non homogènes, d'après M. Peslin
-
 0351 - Page 349 - Chapitre II. Dissociations des systèmes homogènes. 1. - Considérations générales de M. Clausius et de M. Dupré
0351 - Page 349 - Chapitre II. Dissociations des systèmes homogènes. 1. - Considérations générales de M. Clausius et de M. Dupré
-
 0352 - Page 350 - 2. - Température des flammes: Etudes de M. Vicaire
0352 - Page 350 - 2. - Température des flammes: Etudes de M. Vicaire
-
 0356 - Page 354 - 3. - Théorie de la dissociation d'après M. Horstmann. Principes de la théorie
0356 - Page 354 - 3. - Théorie de la dissociation d'après M. Horstmann. Principes de la théorie
-
 0358 - Page 356 - Dissociation des systèmes non homogènes
0358 - Page 356 - Dissociation des systèmes non homogènes
-
 0359 - Page 357 - Dissociation des systèmes homogènes
0359 - Page 357 - Dissociation des systèmes homogènes
-
 0360 - Page 358 - Comparaison de la théorie aux expériences sur le perchlorure de phosphore et le bromhydrate d'amylène
0360 - Page 358 - Comparaison de la théorie aux expériences sur le perchlorure de phosphore et le bromhydrate d'amylène
-
 0361 - Page 359 - Phénomènes d'éthérification / Décomposition de la vapeur d'eau par le fer / Combinaison de l'acide carbonique à l'ammoniac
0361 - Page 359 - Phénomènes d'éthérification / Décomposition de la vapeur d'eau par le fer / Combinaison de l'acide carbonique à l'ammoniac
-
 0362 - Page 360 - Application à l'acide iodhydrique
0362 - Page 360 - Application à l'acide iodhydrique
-
 0363 - Page 361 - 4. - Théorie de la dissociation, d'après M. Gibbs / Principes de la théorie
0363 - Page 361 - 4. - Théorie de la dissociation, d'après M. Gibbs / Principes de la théorie
-
 0365 - Page 363 - Application au perchlorure de phosphore
0365 - Page 363 - Application au perchlorure de phosphore
-
 0367 - Page 365 - Application à l'acide iodhydrique
0367 - Page 365 - Application à l'acide iodhydrique
-
 0369 - Page 367 - 5. - Etudes de M. Moutier
0369 - Page 367 - 5. - Etudes de M. Moutier
-
 0371 - Page 369 - Chapitre III. Résumé et comparaison des diverses théories fondées sur la théorie mécanique de la chaleur
0371 - Page 369 - Chapitre III. Résumé et comparaison des diverses théories fondées sur la théorie mécanique de la chaleur
-
 0373 - Page 371 - Réflexions générales
0373 - Page 371 - Réflexions générales
-
 0375 - Page 373 - Tables des matières
0375 - Page 373 - Tables des matières
-
![0383 - Page 381 - Sur quelques relations de la physique et de la chimie [M. J. Moutier]. Changements d'état non réversibles](https://numerabilis.u-paris.fr/iiif/2/bibnum:pharma_018935x02:0383/square/200,/0/default.jpg) 0383 - Page 381 - Sur quelques relations de la physique et de la chimie [M. J. Moutier]. Changements d'état non réversibles
0383 - Page 381 - Sur quelques relations de la physique et de la chimie [M. J. Moutier]. Changements d'état non réversibles
-
 0388 - Page 386 - Première partie. Le corps peut exister sous deux états différents à la même température / I. - Vaporisation
0388 - Page 386 - Première partie. Le corps peut exister sous deux états différents à la même température / I. - Vaporisation
-
 0392 - Page 390 - II. - Fusion
0392 - Page 390 - II. - Fusion
-
 0395 - Page 393 - 3. - Applications à la chimie
0395 - Page 393 - 3. - Applications à la chimie
-
 0402 - Page 400 - Deuxième Partie. Le corps peu, exister sous trois états différents à la même température / I. - Inégalité de tension des vapeurs émises à la même température par un corps à l'état solide et à l'état liquide
0402 - Page 400 - Deuxième Partie. Le corps peu, exister sous trois états différents à la même température / I. - Inégalité de tension des vapeurs émises à la même température par un corps à l'état solide et à l'état liquide
-
 0406 - Page 404 - II. - Triple point
0406 - Page 404 - II. - Triple point
-
 0409 - Page 407 - III. - Différence des tensions de vapeur émises à la même température par un corps à l'état liquide et à l'état solide
0409 - Page 407 - III. - Différence des tensions de vapeur émises à la même température par un corps à l'état liquide et à l'état solide
-
 0413 - Page 411 - IV. - Applications à la chimie
0413 - Page 411 - IV. - Applications à la chimie
-
 0419 - Page 417 - Dissociation des gaz
0419 - Page 417 - Dissociation des gaz
-
 0429 - Page 427 - Loi de Dulong et Petit / Chaleur spécifique absolue
0429 - Page 427 - Loi de Dulong et Petit / Chaleur spécifique absolue
-
 0432 - Page 430 - Loi de Dulong et Petit pour les gaz parfaits
0432 - Page 430 - Loi de Dulong et Petit pour les gaz parfaits
-
 0435 - Page 433 - Expression générale de la loi de Dulong et Petit
0435 - Page 433 - Expression générale de la loi de Dulong et Petit
-
 0437 - Page 435 - Applications
0437 - Page 435 - Applications
-
![0440 - Page 438 - Sur la Transformation allotropique du phosphore [J. Moutier]](https://numerabilis.u-paris.fr/iiif/2/bibnum:pharma_018935x02:0440/square/200,/0/default.jpg) 0440 - Page 438 - Sur la Transformation allotropique du phosphore [J. Moutier]
0440 - Page 438 - Sur la Transformation allotropique du phosphore [J. Moutier]
-
![0447 - Page 445 - Electro-Chimie [M. Henri Becquerel]. Avant-propos](https://numerabilis.u-paris.fr/iiif/2/bibnum:pharma_018935x02:0447/square/200,/0/default.jpg) 0447 - Page 445 - Electro-Chimie [M. Henri Becquerel]. Avant-propos
0447 - Page 445 - Electro-Chimie [M. Henri Becquerel]. Avant-propos
-
 0449 - Page 447 - Première partie. Chapitre Premier. Dégagement de l'électricité dans les actions chimiques
0449 - Page 447 - Première partie. Chapitre Premier. Dégagement de l'électricité dans les actions chimiques
-
 0459 - Page 457 - Chapitre II. Des piles éléctriques
0459 - Page 457 - Chapitre II. Des piles éléctriques
-
 0463 - Page 461 - Chapitre III. Des forces électrometrices accompagnant les réactions chimiques
0463 - Page 461 - Chapitre III. Des forces électrometrices accompagnant les réactions chimiques
-
 0471 - Page 469 - Actions des dissolutions les unes sur les autres
0471 - Page 469 - Actions des dissolutions les unes sur les autres
-
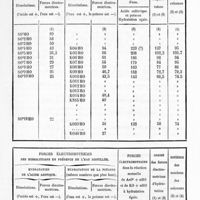 0473 - Page 471 - Forces Electro-motrices. Obtenues par la réaction des acides et des alcalis
0473 - Page 471 - Forces Electro-motrices. Obtenues par la réaction des acides et des alcalis
-
 0484 - Page 482 - Chapitre IV. Relation entre les forces électromotrices et les quantités de chaleur dégagées dans les actions chimiques
0484 - Page 482 - Chapitre IV. Relation entre les forces électromotrices et les quantités de chaleur dégagées dans les actions chimiques
-
 0488 - Page 486 - Chapitre V. De l'électricité de contact
0488 - Page 486 - Chapitre V. De l'électricité de contact
-
 0497 - Page 495 - Deuxième partie. Effets de l'électricité
0497 - Page 495 - Deuxième partie. Effets de l'électricité
-
 0499 - Page 497 - Chapitre Premier. Action des décharges électriques. 1° Etincelles. Arc voltaïque
0499 - Page 497 - Chapitre Premier. Action des décharges électriques. 1° Etincelles. Arc voltaïque
-
 0500 - Page 498 - 2° Effluves Electriques
0500 - Page 498 - 2° Effluves Electriques
-
 0504 - Page 502 - Chapitre II. Action des courants électriques. Décompositions électro-chimiques
0504 - Page 502 - Chapitre II. Action des courants électriques. Décompositions électro-chimiques
-
 0513 - Page 511 - Troisième partie. Formation de divers corps simples et composés avec le concours des forces électriques
0513 - Page 511 - Troisième partie. Formation de divers corps simples et composés avec le concours des forces électriques
-
 0515 - Page 513 - Chapitre Premier. Action de l'électricité sur les subtances insolubles. 1° Appareils simples
0515 - Page 513 - Chapitre Premier. Action de l'électricité sur les subtances insolubles. 1° Appareils simples
-
 0517 - Page 515 - 2° Appareils composés
0517 - Page 515 - 2° Appareils composés
-
 0520 - Page 518 - Action de l'électricité à toute tension sur les substances insolubles
0520 - Page 518 - Action de l'électricité à toute tension sur les substances insolubles
-
 0524 - Page 522 - Actions lentes à diverses températures
0524 - Page 522 - Actions lentes à diverses températures
-
 0526 - Page 524 - De quelques actions lentes
0526 - Page 524 - De quelques actions lentes
-
 0527 - Page 525 - Chapitre II. Des phénomènes électrocapillaires
0527 - Page 525 - Chapitre II. Des phénomènes électrocapillaires
-
 0529 - Page 527 - Formation de divers composés au moyen des appareils électrocapillaires
0529 - Page 527 - Formation de divers composés au moyen des appareils électrocapillaires
-
 0533 - Page 531 - Table des matières
0533 - Page 531 - Table des matières
-
![0535 - Page 533 - Capillarité [M. A. Terquem, Professeur à la faculté des sciences de Lille]](https://numerabilis.u-paris.fr/iiif/2/bibnum:pharma_018935x02:0535/square/200,/0/default.jpg) 0535 - Page 533 - Capillarité [M. A. Terquem, Professeur à la faculté des sciences de Lille]
0535 - Page 533 - Capillarité [M. A. Terquem, Professeur à la faculté des sciences de Lille]
-
 0591 - Page 589 - Viscosité. - Diffusion. - Osmose des fluides. XVIII
0591 - Page 589 - Viscosité. - Diffusion. - Osmose des fluides. XVIII
-
![0617 - Page 615 - Cristallographie [M. Ernest Mallard]. Chapitre Premier. Structure réticulaire des corps cristallisés. Nécessité de la structure réticulaire pour un corps cristallisé homogène](https://numerabilis.u-paris.fr/iiif/2/bibnum:pharma_018935x02:0617/square/200,/0/default.jpg) 0617 - Page 615 - Cristallographie [M. Ernest Mallard]. Chapitre Premier. Structure réticulaire des corps cristallisés. Nécessité de la structure réticulaire pour un corps cristallisé homogène
0617 - Page 615 - Cristallographie [M. Ernest Mallard]. Chapitre Premier. Structure réticulaire des corps cristallisés. Nécessité de la structure réticulaire pour un corps cristallisé homogène
-
 0621 - Page 619 - Conséquences géométriques de la structure réticulaire des corps cristallisés
0621 - Page 619 - Conséquences géométriques de la structure réticulaire des corps cristallisés
-
 0628 - Page 626 - Chapitre II. Symétrie des cristaux. Définition des éléments de symétrie d'une figure
0628 - Page 626 - Chapitre II. Symétrie des cristaux. Définition des éléments de symétrie d'une figure
-
 0630 - Page 628 - Dépendance mutuelle des éléments de symétrie d'une figure / Modes de symétrie compatibles avec la structure particulière des corps cristallisés
0630 - Page 628 - Dépendance mutuelle des éléments de symétrie d'une figure / Modes de symétrie compatibles avec la structure particulière des corps cristallisés
-
 0631 - Page 629 - Influence des éléments de symétrie de l'édifice cristallin sur la formation des cristaux
0631 - Page 629 - Influence des éléments de symétrie de l'édifice cristallin sur la formation des cristaux
-
 0632 - Page 630 - Classification des modes de symétrie distincts qui peuvent appartenir à un système réticulaire. - Systèmes cristallins
0632 - Page 630 - Classification des modes de symétrie distincts qui peuvent appartenir à un système réticulaire. - Systèmes cristallins
-
 0636 - Page 634 - Influence de la symétrie de la molécule. - Holoèdrie. - Mériédrie
0636 - Page 634 - Influence de la symétrie de la molécule. - Holoèdrie. - Mériédrie
-
 0638 - Page 636 - Classification des différents modes d'hémiédrie
0638 - Page 636 - Classification des différents modes d'hémiédrie
-
 0639 - Page 637 - Systèmes cristallins
0639 - Page 637 - Systèmes cristallins
-
 0642 - Page 640 - Chapitre III. Etude des divers systèmes cristallins. I. - Système cubique
0642 - Page 640 - Chapitre III. Etude des divers systèmes cristallins. I. - Système cubique
-
 0643 - Page 641 - Formes simples holoédriques
0643 - Page 641 - Formes simples holoédriques
-
 0646 - Page 644 - Formes hémiédriques. Cas distincts d'hémiédrie
0646 - Page 644 - Formes hémiédriques. Cas distincts d'hémiédrie
-
 0649 - Page 647 - II. - Système sénaire ou hexagonal. Formes simples hoioédriques.
0649 - Page 647 - II. - Système sénaire ou hexagonal. Formes simples hoioédriques.
-
 0652 - Page 650 - Formes mériédriques. III. - Système ternaire ou rhomboédrique
0652 - Page 650 - Formes mériédriques. III. - Système ternaire ou rhomboédrique
-
 0659 - Page 657 - Formes hémiédriques.
0659 - Page 657 - Formes hémiédriques.
-
 0661 - Page 659 - IV. - Système quaternaire ou quadratique. Formes holoédriques
0661 - Page 659 - IV. - Système quaternaire ou quadratique. Formes holoédriques
-
 0664 - Page 662 - Formes hémiédriques
0664 - Page 662 - Formes hémiédriques
-
 0665 - Page 663 - Système terbinaire ou orthorhombique / Formes holéodriques
0665 - Page 663 - Système terbinaire ou orthorhombique / Formes holéodriques
-
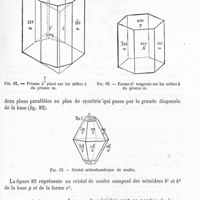 0669 - Page 667 - Formes mériédriques
0669 - Page 667 - Formes mériédriques
-
 0670 - Page 668 - Système binaire ou clinorhombique. Formes holoédriques
0670 - Page 668 - Système binaire ou clinorhombique. Formes holoédriques
-
 0676 - Page 674 - Formes hémiédriques. Système asymétrique, ou anorthique, ou triclinique
0676 - Page 674 - Formes hémiédriques. Système asymétrique, ou anorthique, ou triclinique
-
 0679 - Page 677 - Chapitre IV. Mesure des angles des cristaux. Goniomètre de Wollaston
0679 - Page 677 - Chapitre IV. Mesure des angles des cristaux. Goniomètre de Wollaston
-
 0684 - Page 682 - Chapitre V. Calculs cristallographiques
0684 - Page 682 - Chapitre V. Calculs cristallographiques
-
 0685 - Page 683 - Détermination de la forme primitive au moyen de notations arbitraires données à certaines faces / Principales formules employées dans les calculs cristallographiques
0685 - Page 683 - Détermination de la forme primitive au moyen de notations arbitraires données à certaines faces / Principales formules employées dans les calculs cristallographiques
-
 0688 - Page 686 - Marche générale du calcul / Exemple de calcul cristallographique
0688 - Page 686 - Marche générale du calcul / Exemple de calcul cristallographique
-
 0693 - Page 691 - Discussion de la forme primitive attribuée au cristal
0693 - Page 691 - Discussion de la forme primitive attribuée au cristal
-
 0695 - Page 693 - Chapitre VI. Hémitropie
0695 - Page 693 - Chapitre VI. Hémitropie
-
 0696 - Page 694 - Exemples du premier mode d'hémitropie ou mode perpendiculaire
0696 - Page 694 - Exemples du premier mode d'hémitropie ou mode perpendiculaire
-
 0699 - Page 697 - Groupements des cristaux à forme limite
0699 - Page 697 - Groupements des cristaux à forme limite
-
 0703 - Page 701 - Chapitre VII. Dimorphisme
0703 - Page 701 - Chapitre VII. Dimorphisme
-
 0708 - Page 706 - Chapitre VIII. Isomorphisme
0708 - Page 706 - Chapitre VIII. Isomorphisme
-
 0710 - Page 708 - Volumes moléculaires. - Egalité approximative des volumes moléculaires des substances isomorphes
0710 - Page 708 - Volumes moléculaires. - Egalité approximative des volumes moléculaires des substances isomorphes
-
 0712 - Page 710 - Mélange, dans un même individu cristallin, de plusieurs substances amorphes
0712 - Page 710 - Mélange, dans un même individu cristallin, de plusieurs substances amorphes
-
 0713 - Page 711 - Relation entre les volumes moléculaires des corps composés et ceux des éléments composants
0713 - Page 711 - Relation entre les volumes moléculaires des corps composés et ceux des éléments composants
-
 0715 - Page 713 - Chapitre IX. Mode de production des cristaux. Cristallisation régulière et confuse
0715 - Page 713 - Chapitre IX. Mode de production des cristaux. Cristallisation régulière et confuse
-
 0716 - Page 714 - Cristalissation accompagnant le passage de l'état gazeux à l'état solide / Cristallisation par passage de l'état de fusion ignée à l'état solide
0716 - Page 714 - Cristalissation accompagnant le passage de l'état gazeux à l'état solide / Cristallisation par passage de l'état de fusion ignée à l'état solide
-
 0717 - Page 715 - Cristallisation par le passage de l'état de dissolution à l'état solide
0717 - Page 715 - Cristallisation par le passage de l'état de dissolution à l'état solide
-
 0718 - Page 716 - Cicatrisation des cristaux
0718 - Page 716 - Cicatrisation des cristaux
-
 0720 - Page 718 - Inégale rapidité d'accroissement du cristal suivant les différentes directions. Liaison de ce phénomène avec la production de certaines formes simples
0720 - Page 718 - Inégale rapidité d'accroissement du cristal suivant les différentes directions. Liaison de ce phénomène avec la production de certaines formes simples
-
 0721 - Page 719 - Influence des eaux mères sur la production de certaines formes simples à l'exclusion de certaines autres
0721 - Page 719 - Influence des eaux mères sur la production de certaines formes simples à l'exclusion de certaines autres
-
 0722 - Page 720 - Influence de la température sur la cristallisation
0722 - Page 720 - Influence de la température sur la cristallisation
-
 0723 - Page 721 - Cristaux contenant de l'eau de cristallisation / Expériences de M. Pasteur sur la cristallisation de certaines substances hémiédriques. - Formiate de strontiane
0723 - Page 721 - Cristaux contenant de l'eau de cristallisation / Expériences de M. Pasteur sur la cristallisation de certaines substances hémiédriques. - Formiate de strontiane
-
 0724 - Page 722 - Expériences de M. Pasteur sur la cristallisation de l'acide tartrique et des tartrates
0724 - Page 722 - Expériences de M. Pasteur sur la cristallisation de l'acide tartrique et des tartrates
-
 0725 - Page 723 - Dissolutions sursaturées
0725 - Page 723 - Dissolutions sursaturées
-
 0727 - Page 725 - Corrosion des cristaux
0727 - Page 725 - Corrosion des cristaux
-
![0731 - Page 729 - Phénomènes optiques produits par les substances cristallisées [M. E. Mallard]. I. - Rappel des principes essentiels de la théorie de la lumière. Vibration lumineuse d'une molécule](https://numerabilis.u-paris.fr/iiif/2/bibnum:pharma_018935x02:0731/square/200,/0/default.jpg) 0731 - Page 729 - Phénomènes optiques produits par les substances cristallisées [M. E. Mallard]. I. - Rappel des principes essentiels de la théorie de la lumière. Vibration lumineuse d'une molécule
0731 - Page 729 - Phénomènes optiques produits par les substances cristallisées [M. E. Mallard]. I. - Rappel des principes essentiels de la théorie de la lumière. Vibration lumineuse d'une molécule
-
 0732 - Page 730 - Composition de deux vibrations. - Phase
0732 - Page 730 - Composition de deux vibrations. - Phase
-
 0733 - Page 731 - Propagation des vibrations. - Longueur d'onde
0733 - Page 731 - Propagation des vibrations. - Longueur d'onde
-
 0734 - Page 732 - Composition ou interférence de deux rayons vibrant rectilignement suivant la même direction et se propageant suivant la même droite. - Retard
0734 - Page 732 - Composition ou interférence de deux rayons vibrant rectilignement suivant la même direction et se propageant suivant la même droite. - Retard
-
 0735 - Page 733 - Couleurs des diverses vibrations lumineuses
0735 - Page 733 - Couleurs des diverses vibrations lumineuses
-
 0736 - Page 734 - Réfraction. - Dispersion
0736 - Page 734 - Réfraction. - Dispersion
-
 0737 - Page 735 - II. - Théorie de la double réfraction. Loi générale de la double réfraction. - Ellipsoïde optique inverse
0737 - Page 735 - II. - Théorie de la double réfraction. Loi générale de la double réfraction. - Ellipsoïde optique inverse
-
 0739 - Page 737 - Conséquence de la symétrie des corps cristallisés. - Cristaux uniréfringents, biréfringents.
0739 - Page 737 - Conséquence de la symétrie des corps cristallisés. - Cristaux uniréfringents, biréfringents.
-
 0740 - Page 738 - Axes optiques, cristaux biaxes et uniaxes
0740 - Page 738 - Axes optiques, cristaux biaxes et uniaxes
-
 0742 - Page 740 - III. Polarisation Chromatique. Polariseurs et analyseurs
0742 - Page 740 - III. Polarisation Chromatique. Polariseurs et analyseurs
-
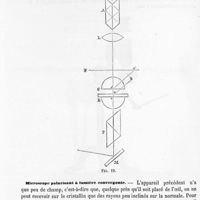
 0743 - Page 741 - Microscope polarisant
0743 - Page 741 - Microscope polarisant
-
 0745 - Page 743 - Lame cristalline observée avec de la lumière homogène
0745 - Page 743 - Lame cristalline observée avec de la lumière homogène
-
 0748 - Page 746 - Lame cristalline observée avec de la lumière blanche
0748 - Page 746 - Lame cristalline observée avec de la lumière blanche
-
 0751 - Page 749 - Lame oblique au faisceau lumineux
0751 - Page 749 - Lame oblique au faisceau lumineux
-
 0752 - Page 750 - Taille de la lame cristalline
0752 - Page 750 - Taille de la lame cristalline
-
 0753 - Page 751 - Production d'une lumière homogène / Emploi de la polarisation chromatique en lumière parallèle pour résoudre certains problèmes cristallographiques
0753 - Page 751 - Production d'une lumière homogène / Emploi de la polarisation chromatique en lumière parallèle pour résoudre certains problèmes cristallographiques
-
 0755 - Page 753 - Phénomènes produits par la superposition de deux lames cristallines. - Lames sensibles
0755 - Page 753 - Phénomènes produits par la superposition de deux lames cristallines. - Lames sensibles
-
 0756 - Page 754 - Lames minces découpées dans les roches
0756 - Page 754 - Lames minces découpées dans les roches
-
 0757 - Page 755 - Dichroïsme. - Manière de la constater. Lumière convergente. Pince à tourmalines
0757 - Page 755 - Dichroïsme. - Manière de la constater. Lumière convergente. Pince à tourmalines
-
 0760 - Page 758 - Microscope polarisant à lumière convergente
0760 - Page 758 - Microscope polarisant à lumière convergente
-
 0762 - Page 760 - Hyperboles obscures. - Lemnicastes ou cercles isochromatiques. / Lame taillée perpendiculairement à l'axe. - Cercles isochromatiques. - Croix noire
0762 - Page 760 - Hyperboles obscures. - Lemnicastes ou cercles isochromatiques. / Lame taillée perpendiculairement à l'axe. - Cercles isochromatiques. - Croix noire
-
 0763 - Page 761 - Signe du cristal
0763 - Page 761 - Signe du cristal
-
 0764 - Page 762 - Lames taillées perpendiculairement à la bissectrice aiguë
0764 - Page 762 - Lames taillées perpendiculairement à la bissectrice aiguë
-
 0767 - Page 765 - Dispersion cristalline
0767 - Page 765 - Dispersion cristalline
-
 0771 - Page 769 - Mesures des constantes optiques. Mesure de l'angle des axes optiques.
0771 - Page 769 - Mesures des constantes optiques. Mesure de l'angle des axes optiques.
-
 0777 - Page 775 - Détermination du signe du cristal
0777 - Page 775 - Détermination du signe du cristal
-
 0779 - Page 777 - Polarisation rotatoire. Pouvoir rotatoire du quartz / Quartz dextrogyres et lévogyres / Lois de la polarisation rotatoire du quartz
0779 - Page 777 - Polarisation rotatoire. Pouvoir rotatoire du quartz / Quartz dextrogyres et lévogyres / Lois de la polarisation rotatoire du quartz
-
 0780 - Page 778 - Couleur d'une lame de quartz normale à l'axe, placée entre deux Nicols croisés
0780 - Page 778 - Couleur d'une lame de quartz normale à l'axe, placée entre deux Nicols croisés
-
 0781 - Page 779 - Cristaux, autres que le quartz, possédant la polarisation rotatoire
0781 - Page 779 - Cristaux, autres que le quartz, possédant la polarisation rotatoire
-
 0782 - Page 780 - Polarisation rotatoire des liquides / Pouvoir rotatoire moléculaire des liquides et des dissolutions
0782 - Page 780 - Polarisation rotatoire des liquides / Pouvoir rotatoire moléculaire des liquides et des dissolutions
-
 0783 - Page 781 - Anomalies des dissolutions d'acide tartrique
0783 - Page 781 - Anomalies des dissolutions d'acide tartrique
-
 0784 - Page 782 - Mesure des pouvoirs rotatoires des liquides
0784 - Page 782 - Mesure des pouvoirs rotatoires des liquides
-
 0785 - Page 783 - Causes de la polarisation rotatoire dans les substances cristallisées
0785 - Page 783 - Causes de la polarisation rotatoire dans les substances cristallisées
-
 0786 - Page 784 - Causes de la polarisation rotatoire dans les liquides et les dissolutions
0786 - Page 784 - Causes de la polarisation rotatoire dans les liquides et les dissolutions
-
![0788 - Page 786 - Les Laboratoires de Chimie. Le Laboratoire de Chimie Inorganique au Muséum [E. Fremy]](https://numerabilis.u-paris.fr/iiif/2/bibnum:pharma_018935x02:0788/square/200,/0/default.jpg) 0788 - Page 786 - Les Laboratoires de Chimie. Le Laboratoire de Chimie Inorganique au Muséum [E. Fremy]
0788 - Page 786 - Les Laboratoires de Chimie. Le Laboratoire de Chimie Inorganique au Muséum [E. Fremy]
-
 0796 - Page 794 - Dispositions générales d'un Laboratoire de Chimie . Destiné à l'enseignement et aux recherches originales
0796 - Page 794 - Dispositions générales d'un Laboratoire de Chimie . Destiné à l'enseignement et aux recherches originales
-
![0800 - Page 798 - Les Laboratoires de l'Ecole Nationale des Mines [M. Ad. Carnot]. Enseignement de la Chimie à l'Ecole des Mines](https://numerabilis.u-paris.fr/iiif/2/bibnum:pharma_018935x02:0800/square/200,/0/default.jpg) 0800 - Page 798 - Les Laboratoires de l'Ecole Nationale des Mines [M. Ad. Carnot]. Enseignement de la Chimie à l'Ecole des Mines
0800 - Page 798 - Les Laboratoires de l'Ecole Nationale des Mines [M. Ad. Carnot]. Enseignement de la Chimie à l'Ecole des Mines
-
 0801 - Page 799 - Bureau d'essai pour les substances minérales
0801 - Page 799 - Bureau d'essai pour les substances minérales
-
 0803 - Page 801 - Disposition des laboratoires
0803 - Page 801 - Disposition des laboratoires
-
 0805 - Page 803 - Historique
0805 - Page 803 - Historique
-
![0810 - Page 808 - Les Laboratoires de Chimie de l'Ecole supérieure de Pharmacie de Paris [M. E. Jungfleisch]](https://numerabilis.u-paris.fr/iiif/2/bibnum:pharma_018935x02:0810/square/200,/0/default.jpg) 0810 - Page 808 - Les Laboratoires de Chimie de l'Ecole supérieure de Pharmacie de Paris [M. E. Jungfleisch]
0810 - Page 808 - Les Laboratoires de Chimie de l'Ecole supérieure de Pharmacie de Paris [M. E. Jungfleisch]
-
![0820 - Page 818 - Appareils et Ustensiles employés en chimie [M. Terreil]](https://numerabilis.u-paris.fr/iiif/2/bibnum:pharma_018935x02:0820/square/200,/0/default.jpg) 0820 - Page 818 - Appareils et Ustensiles employés en chimie [M. Terreil]
0820 - Page 818 - Appareils et Ustensiles employés en chimie [M. Terreil]
-
 0833 - Page 831 - Fourneaux
0833 - Page 831 - Fourneaux
-
![0847 - Page 845 - Généralités sur l'emploi des réactifs [M. Terreil]. Liste des principaux réactifs](https://numerabilis.u-paris.fr/iiif/2/bibnum:pharma_018935x02:0847/square/200,/0/default.jpg) 0847 - Page 845 - Généralités sur l'emploi des réactifs [M. Terreil]. Liste des principaux réactifs
0847 - Page 845 - Généralités sur l'emploi des réactifs [M. Terreil]. Liste des principaux réactifs
-
 0848 - Page 846 - Acides / Réactifs produits par les métaux
0848 - Page 846 - Acides / Réactifs produits par les métaux
-
 0850 - Page 848 - Réactifs pour les essais ou chalumeau
0850 - Page 848 - Réactifs pour les essais ou chalumeau
-
 0852 - Page 850 - Eau / Acides
0852 - Page 850 - Eau / Acides
-
 0855 - Page 853 - Alcalis caustiques / Hydrogène sulfuré
0855 - Page 853 - Alcalis caustiques / Hydrogène sulfuré
-
 0856 - Page 854 - Sulfhydrate d'ammoniaque
0856 - Page 854 - Sulfhydrate d'ammoniaque
-
 0857 - Page 855 - Carbonate de soude
0857 - Page 855 - Carbonate de soude
-
 0858 - Page 856 - Ferro et ferricyanure de potassium / Azotate d'argent / Chlorure de baryum et sels de baryte solubles / Oxalate d'ammoniaque
0858 - Page 856 - Ferro et ferricyanure de potassium / Azotate d'argent / Chlorure de baryum et sels de baryte solubles / Oxalate d'ammoniaque
-
 0859 - Page 857 - Oxygène / Hydrogène / Chlore
0859 - Page 857 - Oxygène / Hydrogène / Chlore
-
 0860 - Page 858 - Brome / Iode / Acide iodhydrique / Acide sulfureux
0860 - Page 858 - Brome / Iode / Acide iodhydrique / Acide sulfureux
-
 0861 - Page 859 - Phosphore / Acide phosphorique anhydre / Perchlorure de phosphore / Oxychlorure de phosphore / Acide arsénieux / Acide arsénique / Acide carbonique / Sulfure de carbone
0861 - Page 859 - Phosphore / Acide phosphorique anhydre / Perchlorure de phosphore / Oxychlorure de phosphore / Acide arsénieux / Acide arsénique / Acide carbonique / Sulfure de carbone
-
 0862 - Page 860 - Acide cyanhydrique / Acide borique / Acide hydrofluosilicique / Iodure de potassium / Cyanure de potassium / Azotate de potasse / Chlorate de potasse
0862 - Page 860 - Acide cyanhydrique / Acide borique / Acide hydrofluosilicique / Iodure de potassium / Cyanure de potassium / Azotate de potasse / Chlorate de potasse
-
 0863 - Page 861 - Bisulfate de potasse / Permanganate de potasse / Bichromate de potasse
0863 - Page 861 - Bisulfate de potasse / Permanganate de potasse / Bichromate de potasse
-
 0864 - Page 862 - Chlorure de sodium / Monosulfure de sodium / Azotate de soude / Phosphate de soude / Biborate de soude ou borax / Chlorhydrate d'ammoniaque ou sel ammoniac / Carbonates d'ammoniaque
0864 - Page 862 - Chlorure de sodium / Monosulfure de sodium / Azotate de soude / Phosphate de soude / Biborate de soude ou borax / Chlorhydrate d'ammoniaque ou sel ammoniac / Carbonates d'ammoniaque
-
 0865 - Page 863 - Phosphate ammoniaco-sodique ou sel de phosphore / Succinate d'ammoniaque / Hydrate de baryte fondu / Eau de baryte / Carbonate de baryte précipité / Chromate de strontiane / Chaux
0865 - Page 863 - Phosphate ammoniaco-sodique ou sel de phosphore / Succinate d'ammoniaque / Hydrate de baryte fondu / Eau de baryte / Carbonate de baryte précipité / Chromate de strontiane / Chaux
-
 0866 - Page 864 - Chaux sodée / Chlorure de calcium / Fluorure de calcium / Chlorure de chaux ou hypochlorite de chaux / Sulfate de chaux / Carbonate de chaux / Magnésie / Sulfate de magnésie mélangé de sel ammoniac
0866 - Page 864 - Chaux sodée / Chlorure de calcium / Fluorure de calcium / Chlorure de chaux ou hypochlorite de chaux / Sulfate de chaux / Carbonate de chaux / Magnésie / Sulfate de magnésie mélangé de sel ammoniac
-
 0867 - Page 865 - Sulfate d'alumine. - Alun / Peroxyde de manganèse / Sulfate ou chlorure de manganèse / Fer / Sulfate de protoxyde de fer / Perchlorure de fer / Acide chromique / Azotate de cobalt
0867 - Page 865 - Sulfate d'alumine. - Alun / Peroxyde de manganèse / Sulfate ou chlorure de manganèse / Fer / Sulfate de protoxyde de fer / Perchlorure de fer / Acide chromique / Azotate de cobalt
-
 0868 - Page 866 - Acétate d'urane / Zinc / Acide molybdique / Etain / Protochlorure d'étain / Plomb pauvre / Protoxyde de plomb / Acide plombique / Carbonate de plomb / Acétate de plomb neutre
0868 - Page 866 - Acétate d'urane / Zinc / Acide molybdique / Etain / Protochlorure d'étain / Plomb pauvre / Protoxyde de plomb / Acide plombique / Carbonate de plomb / Acétate de plomb neutre
-
 0869 - Page 867 - Acétate de plomb tribasique / Azotate de bismuth / Biméta-antimoniate de potasse / Cuivre / Bioxyde de cuivre / Sulfate de cuivre / Tartrate cupro-potassique. - Réactif de Fehling. - Liqueur de Bareswill / Azotate de protoxyde de mercure / Bichlorure de mercure
0869 - Page 867 - Acétate de plomb tribasique / Azotate de bismuth / Biméta-antimoniate de potasse / Cuivre / Bioxyde de cuivre / Sulfate de cuivre / Tartrate cupro-potassique. - Réactif de Fehling. - Liqueur de Bareswill / Azotate de protoxyde de mercure / Bichlorure de mercure
-
 0870 - Page 868 - Argent / Oxyde d'argent / Acétate d'argent / Or / Chlorure d'or / Platine / Bichlorure de platine / Chlorure et azotate de palladium / Alcool
0870 - Page 868 - Argent / Oxyde d'argent / Acétate d'argent / Or / Chlorure d'or / Platine / Bichlorure de platine / Chlorure et azotate de palladium / Alcool
-
 0871 - Page 869 - Ether / Chloroforme, éther acétique, alcool méthylique, alcool amylique, benzine, toluène, pétroles légers, pétroles lourds, essence de térébenthine / Ether iodhydrique ou iodure d'éthyle
0871 - Page 869 - Ether / Chloroforme, éther acétique, alcool méthylique, alcool amylique, benzine, toluène, pétroles légers, pétroles lourds, essence de térébenthine / Ether iodhydrique ou iodure d'éthyle
-
 0872 - Page 870 - Acide picrique / Amidon / Sucre / Levûre de bière / Tannin ou infusion de noix de galle
0872 - Page 870 - Acide picrique / Amidon / Sucre / Levûre de bière / Tannin ou infusion de noix de galle
-
 0873 - Page 871 - Réactifs colorés / Cureuma / Sirop de violette. - Décoction de baies de troëne
0873 - Page 871 - Réactifs colorés / Cureuma / Sirop de violette. - Décoction de baies de troëne
-
 0874 - Page 872 - Campêche. - Cochenille / Violet de méthylaniline / Fluorescine / Fuchsine / Fernambouc / Sulfate d'indigo
0874 - Page 872 - Campêche. - Cochenille / Violet de méthylaniline / Fluorescine / Fuchsine / Fernambouc / Sulfate d'indigo
-
![0875 - Page 873 - Instruction pratique et tableaux élémentaires d'analyse [M. Terreil]](https://numerabilis.u-paris.fr/iiif/2/bibnum:pharma_018935x02:0875/square/200,/0/default.jpg) 0875 - Page 873 - Instruction pratique et tableaux élémentaires d'analyse [M. Terreil]
0875 - Page 873 - Instruction pratique et tableaux élémentaires d'analyse [M. Terreil]
-
 0876 - Page 874 - Explication des tableaux
0876 - Page 874 - Explication des tableaux
-
 0878 - Page 876 - Règles à suivre dans l'étude de l'analyse qualitative
0878 - Page 876 - Règles à suivre dans l'étude de l'analyse qualitative
-
 0879 - Page 877 - Guide pratique pour caractériser un sel métallique en dissolution
0879 - Page 877 - Guide pratique pour caractériser un sel métallique en dissolution
-
 0888 - Page 886 - Marche méthodique à suivre dans l'analyse qualitative des métaux / Examen physique / Essais au chalumeau
0888 - Page 886 - Marche méthodique à suivre dans l'analyse qualitative des métaux / Examen physique / Essais au chalumeau
-
 0889 - Page 887 - Partie soluble dans l'eau / Attaque des matières insolubles dans l'eau par les acides
0889 - Page 887 - Partie soluble dans l'eau / Attaque des matières insolubles dans l'eau par les acides
-
 0890 - Page 888 - Traitement par l'hydrogène sulfuré / Sulfures solubles dans le sulfhydrate d'ammoniaque
0890 - Page 888 - Traitement par l'hydrogène sulfuré / Sulfures solubles dans le sulfhydrate d'ammoniaque
-
 0891 - Page 889 - Sulfures insolubles dans le sulfhydrate d'ammoniaque
0891 - Page 889 - Sulfures insolubles dans le sulfhydrate d'ammoniaque
-
 0893 - Page 891 - Traitement par le sulfhydrate d'ammoniaque
0893 - Page 891 - Traitement par le sulfhydrate d'ammoniaque
-
 0896 - Page 894 - Traitement par le carbonate d'ammoniaque
0896 - Page 894 - Traitement par le carbonate d'ammoniaque
-
 0897 - Page 895 - Recherche des métaux alcalins
0897 - Page 895 - Recherche des métaux alcalins
-
 0898 - Page 896 - Traitement de la partie insoluble dans les acides / Observations
0898 - Page 896 - Traitement de la partie insoluble dans les acides / Observations
-
 0899 - Page 897 - Marché générale. A suivre dans l'analyse qualitative des acides
0899 - Page 897 - Marché générale. A suivre dans l'analyse qualitative des acides
-
 0902 - Page 900 - Observations
0902 - Page 900 - Observations
-
 0903 - Page 901 - Chalumeau. Instruments
0903 - Page 901 - Chalumeau. Instruments
-
 0909 - Page 907 - Charbon
0909 - Page 907 - Charbon
-
 0910 - Page 908 - Des combustibles et de la flamme
0910 - Page 908 - Des combustibles et de la flamme
-
 0911 - Page 909 - Réactifs pour le chalumeau
0911 - Page 909 - Réactifs pour le chalumeau
-
 0913 - Page 911 - Manière d'opérer
0913 - Page 911 - Manière d'opérer
-
 0916 - Page 914 - Caractères généraux qu'on observe dans les essais au chalumeau. Corps qui changent de couleur quand on les chauffe seuls dans le tube bouché
0916 - Page 914 - Caractères généraux qu'on observe dans les essais au chalumeau. Corps qui changent de couleur quand on les chauffe seuls dans le tube bouché
-
 0917 - Page 915 - Corps qui se volatilisent lorsqu'on les chauffe seuls dans le tube bouché
0917 - Page 915 - Corps qui se volatilisent lorsqu'on les chauffe seuls dans le tube bouché
-
 0918 - Page 916 - Corps qui dégagent des gaz ou des vapeurs quand on les chauffe seuls dans le tube bouché / Corps qui présentent des caractères particuliers quand on les chauffe dans le tube bouché avec du bisulfate de potasse
0918 - Page 916 - Corps qui dégagent des gaz ou des vapeurs quand on les chauffe seuls dans le tube bouché / Corps qui présentent des caractères particuliers quand on les chauffe dans le tube bouché avec du bisulfate de potasse
-
 0919 - Page 917 - Corps présentant des réactions particulières quand on les chauffe dans le tube bouché avec du carbonate de soude / Corps qui se volatilisent quand on les soumet au grillage dans le tube ouvert aux deux bouts
0919 - Page 917 - Corps présentant des réactions particulières quand on les chauffe dans le tube bouché avec du carbonate de soude / Corps qui se volatilisent quand on les soumet au grillage dans le tube ouvert aux deux bouts
-
 0920 - Page 918 - Corps présentant des réactions particulières quand on les chauffe seuls sur le charbon, soit au feu d'oxydation, soit au feu de réduction
0920 - Page 918 - Corps présentant des réactions particulières quand on les chauffe seuls sur le charbon, soit au feu d'oxydation, soit au feu de réduction
-
 0922 - Page 920 - Substances qui ne sont point attaquées par la soude et qui restent sur le charbon / Substances qui ne sont point attaquées par la soude, mais qui fondent et disparaissent avec ce réactif dans le charbon / Corps qui forment des perles vitreuses quand on les fond avec de la soude sur le charbon / Métaux dont les composés sont réduits sur le charbon quand on les chauffe avec la soude ou avec un mélange de soude et de cyanure de potassium et qui donnent des auréoles colorées
0922 - Page 920 - Substances qui ne sont point attaquées par la soude et qui restent sur le charbon / Substances qui ne sont point attaquées par la soude, mais qui fondent et disparaissent avec ce réactif dans le charbon / Corps qui forment des perles vitreuses quand on les fond avec de la soude sur le charbon / Métaux dont les composés sont réduits sur le charbon quand on les chauffe avec la soude ou avec un mélange de soude et de cyanure de potassium et qui donnent des auréoles colorées
-
 0923 - Page 921 - Métaux dont les composés sont réduits sur le charbon quand on les chauffe avec la soude ou avec le mélange de soude et de cyanure de potassium mais qui ne donnent point d'auréoles / Substances qui, chauffées avec de la soude et du nitre sur la lame de platine, colorent ces réactifs en vert ou en jaune
0923 - Page 921 - Métaux dont les composés sont réduits sur le charbon quand on les chauffe avec la soude ou avec le mélange de soude et de cyanure de potassium mais qui ne donnent point d'auréoles / Substances qui, chauffées avec de la soude et du nitre sur la lame de platine, colorent ces réactifs en vert ou en jaune
-
 0924 - Page 922 - Recherche des matières minérales toxiques en présence des corps organiques. Recherche de l'arsenic dans les cas d'empoisonnement
0924 - Page 922 - Recherche des matières minérales toxiques en présence des corps organiques. Recherche de l'arsenic dans les cas d'empoisonnement
-
 0928 - Page 926 - Recherche de l'antimoine en présence des matières organiques
0928 - Page 926 - Recherche de l'antimoine en présence des matières organiques
-
 0929 - Page 927 - Recherche du phosphore dans les cas d'empoisonnement
0929 - Page 927 - Recherche du phosphore dans les cas d'empoisonnement
-
 0930 - Page 928 - Recherche du cuivre et du plomb dans les substances alimentaires et dans les cas d'empoisonnement
0930 - Page 928 - Recherche du cuivre et du plomb dans les substances alimentaires et dans les cas d'empoisonnement
-
 0931 - Page 929 - Recherche du mercure en présence des matières organiques
0931 - Page 929 - Recherche du mercure en présence des matières organiques
- Univers Numerabilis
- Pharmacie
- Sur l'auteur
- Fremy, Edmond (1814 - 1894)
- Identifiant SUDOC
- Notice dans le Sudoc
